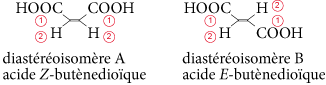stéréochimie

Domaine de la chimie qui étudie la structure spatiale des molécules, ainsi que ses conséquences sur leurs propriétés physico-chimiques.
« Stéréochimie est synonyme de chimie dans l’espace ». Cette définition est celle donnée par les chimistes Joseph Le Bel et Jacobus Van’t Hoff en 1874. Cependant, cette définition serait erronée si par voie de conséquence elle consacrait l’existence de deux chimies dont l’une serait spatiale. Les réactions chimiques, qui impliquent une approche des réactifs et l’établissement d’un état de transition, ont toujours lieu dans un espace à trois dimensions. De plus, les molécules dont nous examinons la structure ne sont pas complètement définies par une formule plane ; il est donc indispensable de spécifier la position relative des atomes les uns par rapport aux autres.
En fait, stéréochimie et chimie sont indissociables. En effet, la chimie à deux dimensions ne fait intervenir que les formules brutes ou les formules développées (ou semi-développées) planes et elle se révèle totalement insuffisante dès qu’un phénomène chimique (mécanisme réactionnel par exemple) est examiné dans le détail. Les modèles moléculaires et leur représentation symbolique plane sont une aide précieuse pour le chimiste, qui peut prévoir les isoméries (arrangements différents des atomes d’une molécule à partir d’une formule brute) et interpréter des réactions. La stéréochimie met donc l’accent sur l’aspect stérique de la chimie, et des informations précieuses sont obtenues en examinant une réaction, si simple soit-elle, sous l’angle de sa stéréochimie.
1. Historique de la stéréochimie

C’est le physicien français Jean-Baptiste Biot qui ouvre la voie à la stéréochimie en 1815 en découvrant l’activité optique, propriété qu’ont certaines substances organiques de modifier la polarisation de la lumière. Puis en 1848, Louis Pasteur utilise ce principe et parvient à séparer deux variétés cristallines, image l’une de l’autre dans un miroir : le tartrate double de sodium et d’ammonium (formé à partir de l’acide tartrique racémique). Ce premier dédoublement spontané d’un composé dit racémique (mélange 50/50 de chacun des deux énantiomères, image l’un de l’autre dans un miroir plan mais non superposables) met en évidence une isomérie particulièrement importante, l’isomérie optique. Dès lors, la stéréochimie va jouer un rôle incontournable dans le développement de la chimie.

Une trentaine d’années plus tard, Joseph Le Bel et Jacobus Van’t Hoff s’appuient principalement sur l’isomérie optique des composés pour établir la structure tétraédrique du carbone. En effet, le centre d’asymétrie de l’atome de carbone imprime une rotation inverse sur la lumière polarisée à chaque énantiomère.
La disposition des liaisons autour d’un atome d’azote est également étudiée par des méthodes stéréochimiques. On montre que les ammoniums quaternaires et les oxydes d’azote peuvent être optiquement actifs. L’azote dans ces composés n’a donc pas une structure plane. Les composés du soufre, phosphore, arsenic... sont également examinés par ces techniques
La chimie des complexes métalliques progresse considérablement à la suite des travaux d’Alfred Werner, qui obtient le prix Nobel de chimie en 1913. Werner pose l’hypothèse révolutionnaire que le cobalt ou le nickel sont octaédriques dans les complexes où ces métaux sont hexacoordonnés. L’atome métallique est au centre d’un octaèdre et les coordinats sont disposés sur les sommets. Cette représentation des liaisons chimiques autour du métal est particulièrement féconde et permet de prévoir toutes les isoméries possibles en fonction de la nature des coordinats.
2. Stéréochimie statique et dynamique
La stéréochimie peut se manifester sous un double aspect, statique ou dynamique.
2.1. La stéréochimie statique
La stéréochimie statique groupe toutes les données concernant la structure des molécules, c’est-à-dire la localisation dans l’espace des atomes les uns par rapport aux autres. Dans bien des cas la molécule n’est pas rigide et sa forme peut varier selon la température ou la nature des substituants. Ces variations, en général dues à des rotations autour de liaisons simples, sont étudiées grâce à l’analyse conformationnelle. La stéréochimie permet de prévoir le nombre de stéréoisomères correspondant à une formule développée (ou semi-développée) plane donnée.
Des méthodes ont été mises au point pour étudier la stéréochimie des molécules. Celles-ci sont indispensables dans la chimie des produits naturels pour définir complètement la structure d’un composé qui a été isolé. L’intérêt d’une telle détermination n’est pas purement académique ; les répercussions sont considérables si la substance possède une activité thérapeutique, la connaissance de sa structure rendant alors possible une synthèse partielle ou totale à l’échelon industriel. Citons l’exemple de la cortisone : quelques milligrammes existent dans le monde en 1945, la découverte de son action anti-inflammatoire date de 1947, sa synthèse partielle à partir d’acides biliaires est effectuée dès 1950 à l’échelle du kilogramme.
2.2. La stéréochimie dynamique
La stéréochimie dynamique concerne la réactivité des molécules. La connaissance de l’encombrement spatial d’une réaction signifie qu’il faut déterminer la stéréochimie des produits formés et définir le chemin réactionnel ainsi que la géométrie de l’état de transition.
Le contrôle stérique en synthèse est très important ; ainsi, un composé (par exemple, la pénicilline) dont la formule plane comporte trois carbones asymétriques (carbone lié à quatre groupements de natures différentes) peut exister sous forme de 23 = 8 stéréoisomères distincts ; mais un seul isomère possède l’activité antibiotique désirée.
L’étude de la stéréochimie dynamique est un moyen irremplaçable pour obtenir des informations très précises sur les mécanismes réactionnels (réactions ioniques, radicalaires, photochimiques et même enzymatiques). Un exemple célèbre est celui de l’inversion de Walden : dès 1903, Paul Walden montre, en travaillant sur les molécules optiquement actives, que certains cas de substitution nucléophile (appelée SN2) impliquent une inversion de configuration, donc un « renversement » du tétraèdre initial.
L’étude de la stéréochimie utilise le fait qu’il existe des paramètres que l’on peut considérer comme quasi invariants lorsque l’on passe d’un composé à un autre. Ainsi, il n’est pas nécessaire de repartir de zéro pour étudier tout nouveau composé. En effet, les longueurs de liaisons entre atomes ainsi que les angles que font les liaisons entre elles varient très peu d’un composé à un autre.
Des isomères sont appelés stéréoisomères lorsqu’ils ne diffèrent que par la disposition de leurs atomes dans l’espace. Du fait du caractère tétraédrique du carbone, le problème de la représentation plane d’une structure tridimensionnelle se pose.
3. Les différents modes de représentations
Divers modes de représentation sont utilisés : représentations de Fischer, de Cram, de Newman... et chacun de ces modes possède ses propres conventions qu’il faut impérativement respecter.
3.1. Représentation de Fischer
La représentation de Fischer est particulièrement adaptée à la chimie des glucides, où les aspects stéréochimiques sont importants.
Les quatre liaisons d’un carbone saturé (→ chimie organique) sont représentées par des traits pleins, avec la convention suivante :
• un trait vertical correspond à une liaison située dans la plan de la feuille ou en arrière de ce plan ;
• un trait horizontal correspond à une liaison dirigée en avant du plan de la feuille.
• la chaîne carbonée principale se situe sur la verticale.
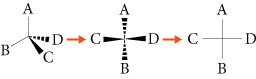
3.2. Représentation de Cram
La représentation de Cram d’une molécule permet de la représenter en trois dimensions sur un support à deux dimensions. Elle fait apparaître les liaisons de la molécule en perspective les unes par rapport aux autres afin de comprendre la structure dans l’espace de la molécule.
Les liaisons entre les atomes sont représentées de la façon suivante :
• liaison dans le plan de la feuille :
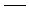
• liaison en avant du plan de la feuille :
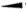
• liaison en arrière du plan de la feuille :
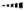
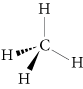
Par exemple, le méthane de formule CH4 a la représentation de Cram suivante :
3.3. Représentation de Newman
La représentation de Newman d’un composé organique est sa représentation sur papier permettant de visualiser ses différentes conformations (positions des atomes d’une molécule par rotation des liaisons simples carbone-carbone).
Pour représenter une molécule dans une projection de Newman il faut regarder la molécule dans l’axe d’une liaison simple carbone-carbone, puis on représente les liaisons entre tous les atomes ou groupes d’atomes sur un plan perpendiculaire à l’axe de la liaison carbone-carbone.
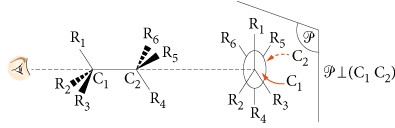
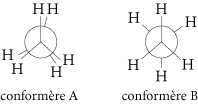
De manière générale, la conformation la plus stable est celle pour laquelle les substituants des atomes de carbone exercent le moins d’interactions possibles les uns sur les autres, autrement dit la conformation dans laquelle ils sont le plus éloignés les uns des autres. Par exemple, dans la représentation de Newman des conformères de l’éthane en position éclipsée (conformère A) et décalée (conformère B), le conformère le plus stable est le conformère B.
4. Stéréoisomérie
Une molécule est dite chirale (prononcer « kiral ») si son image par rapport à un miroir ne lui est pas superposable. Une molécule chirale ne possède ni centre ni plan de symétrie. Dans le cas contraire, on dit qu’elle est achirale.
À une substance chirale correspond toujours un isomère stérique, son énantiomère.
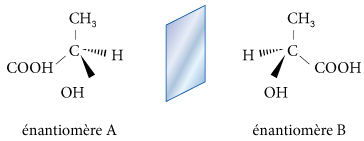
Deux énantiomères dévient en sens inverse et d’un angle égal le plan d’une lumière polarisée plane ; on mesure alors le pouvoir rotatoire. C’est la raison pour laquelle on parle d’isomérie optique.
Les mélanges équimoléculaires d’énantiomères sont choses courantes. Ce sont des mélanges dits racémiques. Le pouvoir rotatoire d’un racémique est nul par suite de la compensation des rotations de chacun des énantiomères.
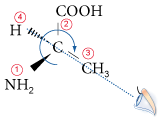
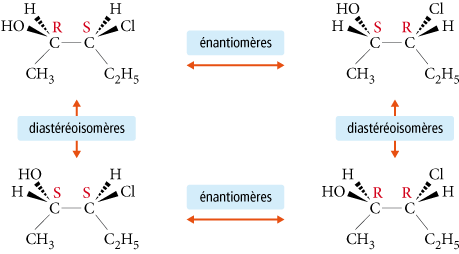
Un carbone est dit asymétrique lorsqu’il est relié à quatre groupements de natures différentes. Pour distinguer les carbones asymétriques entre eux, on utilise une nomenclature spécifique basée sur leur configuration : la nomenclature en R/S de Cahn, Ingold et Prelog. Par exemple, la configuration du carbone asymétrique de l’analine est R (de rectus, droit car les groupes tournent dans le sens des aiguilles d’une montre).
Les diastéréoisomères sont des stéréoisomères de configuration qui ne sont pas énantiomères (ils ne sont pas images l’un de l’autre dans un miroir). Ils peuvent être chiraux ou achiraux.
Les molécules contenant des liaisons multiples peuvent également être des diastéréoisomères. Exemple : l’acide maléique (ou acide butènedioïque) existe sous deux configurations :