électrolyse
Décomposition chimique produite par un courant électrique.
Certaines réactions d’oxydoréduction spontanées peuvent servir à la production et au stockage d’énergie électrique. Elles sont généralement mises à profit dans certains dispositifs appelés piles. À l’inverse, une transformation chimique peut être induite par le passage du courant électrique à travers une substance : c’est le procédé d’électrolyse.
1. Découverte du phénomène d’électrolyse

On attribue la découverte du phénomène d’électrolyse au Britannique Michael Faraday au début du xixe siècle. Il est en effet l’un des premiers à montrer que le passage du courant dans certains électrolytes peut provoquer des réactions chimiques qui n’auraient pas eu lieu autrement.
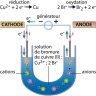
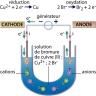
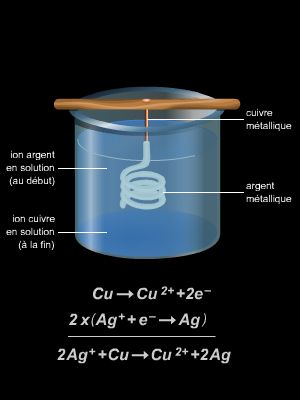
Une des premières cellules qu’il étudie est constituée de deux électrodes, une anode en platine et une cathode en platine platiné (platine recouvert d’une fine couche de noir de platine) reliées entre elles par un générateur (le pôle + étant relié à l’anode). Ces électrodes plongent dans une solution de sulfate de cuivre molaire. En imposant un courant suffisant à travers ce dispositif, il parvient à observer un dépôt de cuivre sur la cathode, correspondant à la réaction chimique suivante (réduction) :
Cu2+(aq) + 2e− → Cu
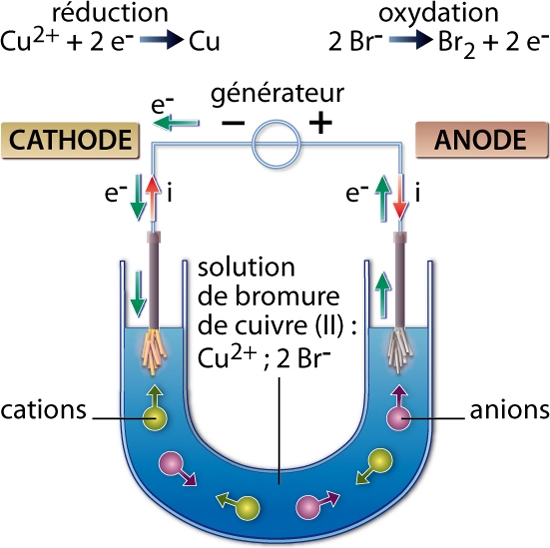
2. Principe de fonctionnement d’un dispositif à électrolyse
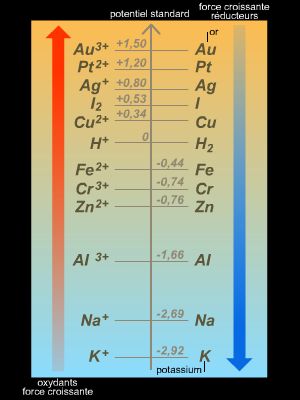
En travaillant sur d’autres solutions électrolytiques, Faraday est parvenu à la conclusion que, pour forcer une réaction dans le sens opposé à son sens d’évolution spontanée, il fallait relier les électrodes à une source possédant un potentiel supérieur (redox) à celui qu’aurait la cellule à électrolyse (→ électrochimie) si elle fonctionnait en mode pile (en veillant à relier l’électrode sur laquelle on souhaite observer une oxydation au pôle + du générateur).
La réaction d’oxydoréduction qui a lieu dans une cellule d’électrolyse est donc endoénergétique (c’est-à-dire qu’elle consomme de l’énergie) et nécessite l’utilisation d’un générateur de courant électrique.
On retiendra que l’électrolyse a lieu à la surface des électrodes : à l’anode se produit une oxydation et à la cathode une réduction.
2.1. Exemple de l’électrolyse de l’eau
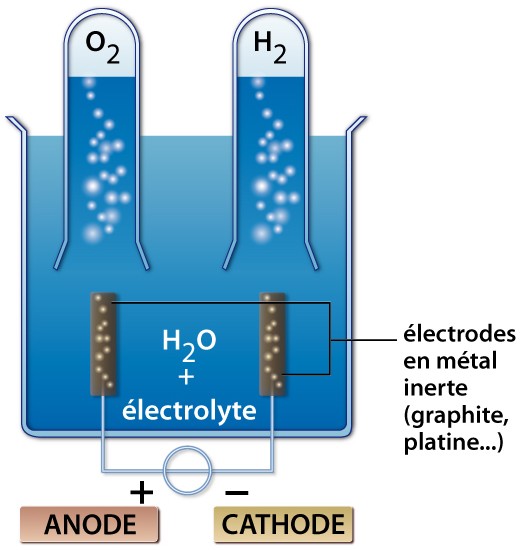
La réaction que l’on souhaite provoquer est :
2 H2O(l) → 2 H2(g) + O2(g)
Pour que l’électrolyse puisse fonctionner, il est nécessaire d’imposer un minimum de 1,23 V [car on a E0(H2O/H2) = 0,42 V et E0(O2/OH−) = − 0,81 V] par l’intermédiaire du générateur.
En réalité, cette condition nécessaire est non suffisante. Comme à chaque fois qu’il y a électrolyse, différents facteurs cinétiques interviennent et imposent l’application d’une tension minimale de 1,8 V environ : c’est le phénomène de surtension.
2.2. Réactions compétitives lors d'une électrolyse
Dans toute cellule électrolytique sont à la fois présentes les espèces chimiques auxquelles on souhaite faire subir le phénomène d’électrolyse et d’autres espèces qui constituent les électrodes par exemple ou qui apparaissent dans l’électrolyte (comme l’eau bien souvent).
Il faut veiller, lorsque l’on réalise une électrolyse, à ce que les espèces qui sont effectivement réduites ou oxydées soient réellement celles que l’on souhaite. Pour cela, il faut analyser au préalable les divers potentiels d’oxydoréduction des espèces présentes (redox). Par exemple, la réalisation de l’électrolyse de l’eau en utilisant une électrode de cuivre [E0(Cu2+/Cu) = 0,34 V] conduirait de manière évidente à la réduction immédiate du cuivre et non de l’eau (de manière générale, entre deux couples, la réaction a lieu entre l’oxydant du couple ayant le potentiel le plus élevé et le réducteur du couple ayant le potentiel le plus faible).
3. Lois de l’électrolyse ou lois de Faraday
En 1833, Michael Faraday énonce les deux lois fondamentales de l’électrolyse :
• la première loi stipule que les quantités d’électrons mises en jeu à l’anode et à la cathode sont strictement les mêmes ;
• la deuxième loi stipule que la quantité de matière d’une substance formée (ou consommée) par la réduction à la cathode (ou par l’oxydation à l’anode) est proportionnelle à la quantité d’électricité ayant traversée la cellule d’électrolyse au cours de la réaction. Cette loi se résume par l’équation suivante :
Q = − n F ΔE, où Q est la quantité d’électricité (en coulombs), n est le nombre d’électrons échangés, F est la constante de Faraday (F = 96 500 coulombs par mole d’électrons), et ΔE est la différence de potentiel aux électrodes.
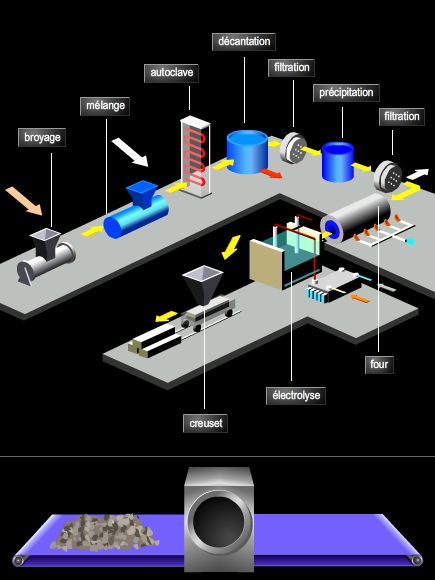
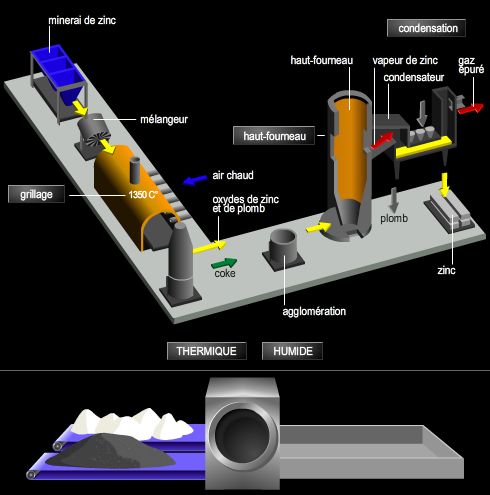
4. Les applications industrielles de l’électrolyse
Les applications de l’électrolyse sont très nombreuses et concernent des domaines très variés, principalement la métallurgie, les sciences des matériaux et des traitements de surface, ainsi que la chimie organique (électrosynthèse).
4.1. La fabrication de la soude et du dichlore
La principale difficulté de cette fabrication réside dans la compétition qui existe à la cathode entre la réduction de l’eau et la réduction de Na+.
4.1.1. Le procédé Chlore-alcali
Ce procédé repose sur l’électrolyse de solutions de chlorure de sodium très concentrées (plus facilement réductibles) de manière à observer la formation de sodium à la cathode et non de dihydrogène. La soude et le dichlore produits sont séparés au fur et à mesure de leur synthèse afin d’éviter qu’ils ne réagissent entre eux.
4.1.2. Le procédé Downs
Ce procédé repose sur l’électrolyse de chlorure de sodium fondu dont la réduction se fait plus facilement que celle de l’eau.
4.2. Le plaquage électrolytique
En utilisant, par exemple, une solution électrolytique de cyanure d’argent, on peut recouvrir d’argent un objet en effectuant une électrolyse dont la cathode est constituée de l’objet en question.
4.3. L’obtention de métaux purs
L’électrolyse constitue une méthode de choix pour la purification des métaux. Par exemple, en utilisant un électrolyte à base d’hexafluorure d’aluminium III, on peut obtenir de l’aluminium très pur tout en travaillant à des températures inférieures à 1 000 °C : c’est le procédé Hall.