élément

Entité chimique fondamentale commune aux diverses variétés d'un même corps simple ainsi qu'aux combinaisons de ce corps simple avec d'autres corps.
CHIMIE
1. Historique de la notion d'élément
1.1. Les conceptions anciennes
Il est aisé de constater que les corps sont faits de matières différentes, le bois, le fer, etc. Une fois acquis qu'une matière peut être constituée de plusieurs substances – le bronze est obtenu par le mélange du cuivre et de l'étain –, il était naturel de s'interroger sur la composition de toute matière. La diversité des propriétés des substances oriente vers l'idée qu'elles sont constituées, selon différentes combinaisons, d'un petit nombre de substances élémentaires. Ce sont les qualités de ces éléments qui expliqueraient celles des matières composées.

De là naquit, parmi différentes théories, celle des quatre éléments, attribuée à Empédocle d'Agrigente (ve s. avant J.-C.), qui a joui d'une grande faveur jusqu'au xviiie s. : la terre, le feu, l'air et l'eau sont les noms couramment donnés à ces éléments. Aristote (ive s. avant J.-C.) perfectionna cette conception en leur attribuant des qualités, comme le chaud et l'humide. La quintessence était un cinquième élément, plus subtil, exemple parmi d'autres de ce qu'une spéculation sans frein n'a pas manqué de produire. L'alchimie, dans sa visée de connaissance et de maîtrise de la matière, y participa largement.
1.2. Du xviie s. à Mendeleïev

Au xviie s. la chimie, encore peu distincte de l'alchimie, commença à devenir plus scientifique : la connaissance devenait celle de la société des savants, et non plus le secret de quelques uns ; et l'usage de l'expérimentation commençait à relever d'une attitude plus méthodique. On en observe un effet dans la nouvelle définition des éléments que proposa Robert Boyle (1627-1691) : on doit désigner par ce mot les matières qui, à l'expérience, résistent à toute tentative de décomposition. Cette nouvelle conception allait s'imposer petit à petit contre l'ancienne, jusqu'à triompher à l'époque de Lavoisier. Cette notion expérimentale d'élément avait comme faiblesse d'être relative aux possibilités techniques d'analyse du moment. Tel corps qui a résisté à toutes les tentatives de décomposition peut, analysé selon une méthode nouvelle, révéler une structure composée.

Au cours du xixe s., les chimistes identifièrent quelques dizaines d'éléments. La quête chimique étant devenue attentive à la mesure des quantités, des « poids » notamment, des rapports simples apparurent dans les résultats, et la théorie atomique fut remise en chantier pour les expliquer. On associa aux éléments divers types d'atomes, différant les uns des autres, pour le moins, par leurs masses. En les classant par « poids atomique » croissant, Dimitri Mendeleïev (1834-1907) observa que certaines propriétés revenaient périodiquement. Il put ainsi classer les 63 éléments connus en un tableau rectangulaire. Certaines cases restant vides, Mendeleïev put prédire l'existence des éléments correspondants ainsi que leurs propriétés, et l'expérience lui donna bientôt raison.
1.3. La conception moderne
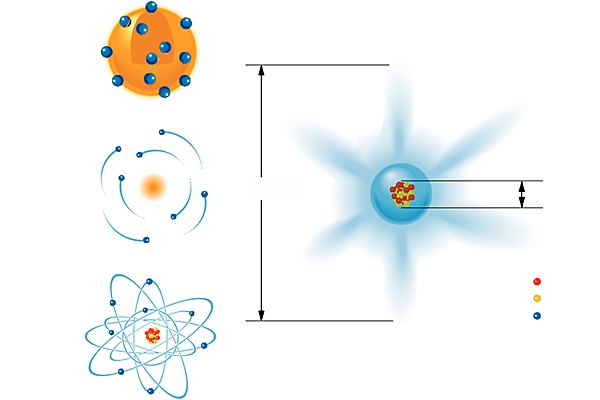
Au début du xxe s., lorsque l'on a commencé à connaître la structure de l'atome – un noyau autour duquel gravitent des électrons –, il est devenu possible de redéfinir la notion d'élément. On appelle ainsi, depuis, un type d'atome : il est caractérisé par son numéro atomique Z, qui est le nombre des protons présents dans son noyau. C'est aussi celui des électrons, tant qu'il n'y a pas ionisation.
Pour un même numéro atomique, le nombre des neutrons peut subir quelques variations : par exemple, le chlore (Z = 17) en a 20 dans un cas sur quatre et 18 dans les trois autres. Comme le chlore, tout élément peut donc présenter des isotopes, dont les propriétés chimiques sont semblables puisqu'elles sont liées, pour l'essentiel, à la structure électronique.
Un élément n'est pas nécessairement un corps, en ce sens que l'on ne le trouve pas toujours tel quel dans la nature. Dans les conditions ordinaires, par exemple, il n'y a pas de gaz dont les corpuscules seraient les atomes d'oxygène (O). Celui que l'on désigne traditionnellement par ce nom est appelé dioxygène par les chimistes ; ses molécules sont faites de deux atomes (O2). L'ozone (O3), quoique constitué du même élément O, est un autre corps simple.
2. La dénomination des éléments
Chaque élément est donc exprimé par un symbole et un numéro d'ordre, le numéro atomique (symbole Z).
Le premier élément a pour symbole H et pour numéro atomique Z = 1. On l'appelle hydrogène. Le deuxième a pour symbole He et pour numéro atomique Z = 2. On l'appelle hélium. Et ainsi de suite.
Les noms des éléments sont d'origine très variée : inconnue pour certains, qui sont en usage depuis la nuit des temps, elle est pour d'autres liée aux circonstances de leur découverte ou aux caractéristiques de l'élément. L'hydrogène doit son nom au fait qu'il « engendre l'eau » (par combustion), le phosphore au fait qu'il « apporte la lumière », le chlore à sa couleur d'un « vert jaunâtre » : les trois noms ont été construits sur les racines grecques correspondantes. Les chimistes ont aussi créé des noms à partir de mots d'origine latine : rubidium signifie « rouge » ; l'iridium a été baptisé par référence à la variété des couleurs obtenues par sa dissolution dans les acides…
L'hélium a été découvert dans le spectre de la lumière solaire : son nom vient du mot grec désignant le Soleil. Le hafnium a été ainsi nommé par Coster et Hevesy en 1923 : ce nom, qui vient de Hafnia (ancienne appellation latine de Copenhague) a été définitivement adopté, après des dénominations très variées (norium en 1845, jargonium en 1869, nigrium puis celtium en 1911) dues aux longues vicissitudes qui ont accompagné sa découverte.
Le rhénium (Rhin) a été nommé ainsi par ses inventeurs, trois Allemands travaillant dans le laboratoire Nernst en 1925. En 1830, Nils Sefström appela vanadium un élément qu'il venait de découvrir, en l'honneur de la déesse scandinave de l'Amour, Vanadis.
Plus récemment, les noms de mendélévium, nobélium et lawrencium ont été donnés aux éléments 101, 102 et 103 en hommage à leurs découvreurs. À partir de l'élément 104, la communauté scientifique internationale a décidé d'attribuer désormais à tout élément un nom systématique, construit avec le suffixe « -ium » sur les racines des trois mots latins signifiant les trois chiffres de son numéro atomique, conformément au tableau suivant, et un symbole construit avec les initiales des trois racines concernées. Par exemple :
104 – unnilquadium – Unq
105 – unnilpentium – Unp
118 – ununoctium – Uuo
Mais ces noms systématiques sont ensuite remplacés par des noms moins « anonymes », après la confirmation de la découverte des éléments correspondants et entente entre leurs découvreurs et la communauté scientifique internationale. Ainsi, l'Union internationale de chimie pure et appliquée (IUPAC) a finalement attribué le nom de rutherfordium à l’élément 104, dubnium au 105, seaborgium au 106, bohrium au 107, hassium au 108, meitnerium au 109, darmstadtium au 110, roentgenium au 111, copernicium au 112, flérovium au 114 et livermorium au 116. Ces deux derniers éléments font directement référence au lieu de leur découverte : le Lawrence Livermore National Laboratory (États-Unis) et le Flerov Laboratory of Nuclear Reactions (Russie). En 2016, les éléments 113, 115, 117 et 18 ont été officiellement baptisés respectivement nihonium (Nh, de nihon, Japon), moscovium (Mc, de Moscou, capitale russe), tennessine (Ts, de Tennesse, État américain) et oganesson (Og, du n. de Y. Oganessian, physicien nucléaire russe).
3. La classification périodique des éléments
3.1. Une case, un élément
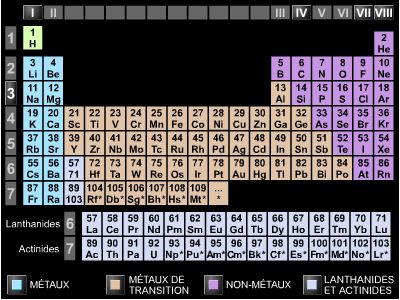
La classification périodique des éléments se présente sous la forme d'un tableau qui recense tous les éléments connus. Chacun d'entre eux y occupe une case et est désigné par son symbole, accompagné de deux nombres. Le plus petit, toujours entier, est le numéro atomique Z (correspondant au nombre de protons) ; il augmente d'unité en unité, à partir de 1.
L'autre est la masse molaire atomique M, appelée aussi masse molaire ou masse atomique. Cette dernière appellation reprend et corrige l'ancienne expression de « poids » atomique. Elle a cependant l'inconvénient de paraître désigner la masse de l'atome considéré, ce qui n'est pas le cas. Cette grandeur est la masse d'une mole de l'atome en question, autrement dit la masse de 6,02 × 1023 atomes de l'élément considéré (6,02 × 1023 étant le nombre d’Avogadro) ; elle s'exprime en grammes par mole (g.mol−1).
La valeur de cette masse est souvent proche d'un entier, au point que les tableaux simplifiés donnent presque exclusivement des entiers. Ainsi l'hélium, de numéro atomique 2, a-t-il pour masse molaire 4,0026 g.mol−1, ce que l'on arrondit à 4. Cet entier A, le nombre de masse, correspond en fait au nombre de nucléons, c'est-à-dire le nombre de protons et de neutrons composant le noyau atomique. Puisque Z = 2, l'atome d'hélium comporte deux électrons ainsi que deux protons. Puisque A = 4, le nombre des neutrons est N = A − Z = 2.
Les masses molaires éloignées d'une valeur entière sont liées à la présence non négligeable d'un isotope. Ainsi, dans le cas du chlore (Z = 17), l'isotope 35 (18 neutrons) se rencontrant trois fois plus que l'isotope 37 (20 neutrons), on prend 35,5 comme masse molaire moyenne de l'élément chlore. En conséquence, la masse molaire moléculaire du dichlore (Cl2) a pour valeur 71.
3.2. Lignes et colonnes
Les différentes lignes du tableau périodique correspondent au remplissage des différentes couches électroniques des atomes. La première couche, la plus proche du noyau, ne peut recevoir que deux électrons. C'est pourquoi la première ligne ne comporte que deux cases : H et He. La deuxième couche peut recevoir huit électrons : dans la deuxième ligne, le numéro atomique va de 3 à 10 ; etc.
Chaque colonne, par conséquent, correspond à la façon dont est occupée la dernière couche électronique de chaque atome. Dans la première colonne figurent les éléments pour lesquels la couche la plus externe comporte un unique électron. L'hydrogène (H), en tête, n'en a qu'un en tout ; le lithium (Li), en dessous, en a 3 (= 2 + 1) ; le sodium (Na, pour natrium), sur la troisième ligne, possède 11 électrons (= 2 + 8 + 1) etc.
C'est ce nombre des électrons de la couche externe (également appelée couche de valence) qui détermine les propriétés chimiques des corps, expliquant que les différents éléments d'une même colonne présentent des propriétés commune. La première colonne est celle des métaux alcalins (lithium, sodium, etc.) ; la dernière colonne est celle des gaz rares, ou inertes (hélium, néon, argon, etc.), l'avant-dernière étant celle des halogènes (fluor, chlore, etc.).
Le principe de remplissage des lignes du tableau qui vient d'être esquissé n'est pas respecté partout. Les irrégularités de sa constitution tiennent au fait que le remplissage des couches électroniques suit, dans certains domaines, des règles un peu plus compliquées. On notera, en particulier, la famille des actinides, où figure l'uranium (U), de numéro atomique 92. Tous les éléments qui viennent après sont les transuraniens : ils n'existent pas dans la nature, ils ont été produits artificiellement.
4. Les éléments radioactifs et leurs transmutations
La physique nucléaire, contrairement à la chimie, prend en compte des réactions dans lesquelles des noyaux atomiques se transforment. On peut donc y voir de véritables transmutations d'éléments.
Le concept de nucléide (ou nuclide) qui a cours dans cette branche de la physique n'est autre que celui de type de noyau, défini par les nombres Z et A. Autrement dit, le cortège électronique n'est pas pris en considération.
4.1. Radioactivité et stabilité des éléments
Le phénomène de la radioactivité peut prendre différentes formes. Des noyaux de plutonium 244, par exemple (94 protons et 150 neutrons), émettent une particule, constituée de deux protons et de deux neutrons. Cette dernière est donc en fait un atome d'hélium complètement ionisé He2+ ou, si l'on préfère, un noyau d'hélium. Le noyau émetteur n'ayant plus que 92 protons, le plutonium est devenu uranium, sous la forme de l'uranium 240.
En se désintégrant, le noyau « père » donne un noyau « fils » qui peut à son tour être radioactif. De proche en proche on aboutit in fine à un nucléide stable.
La radioactivité est un phénomène naturel qui affecte surtout les gros noyaux (uranium, radium, polonium…), mais pas uniquement. La désintégration du carbone 14 obéissant à une loi connue, la présence de cet isotope permet la datation des fossiles. La radioactivité artificielle consiste à modifier un noyau lourd en le bombardant avec un projectile, qui peut être une particule, de façon à produire un nouveau noyau qui soit radioactif.
4.2. Production et utilisations énergétiques des éléments transuraniens
Les transuraniens sont des éléments radioactifs. On les obtient artificiellement et leur durée de vie peut être très brève. Parmi ceux déjà produits, celui qui a le plus grand numéro atomique est l'élément 116, qui a été obtenu en 2000 et dénommé Livermorium (Lv) en 2012. Ses 176 neutrons le rendent proche d'un îlot de stabilité, prévu par la théorie, qui serait atteint avec 184 neutrons.
La fission nucléaire consiste à casser des noyaux lourds, d'uranium par exemple, dans le but de produire une grande quantité d'énergie, que ce soit de façon brutale (bombe atomique) ou de façon contrôlée (électronucléaire) ; dans cette réaction, l'uranium disparaît en donnant deux autres éléments.
La fusion nucléaire vise au même but, mais par l'opération inverse : un noyau de deutérium (ou hydrogène 2) et un de tritium (ou hydrogène 3) fusionnent pour donner un atome d'hélium. Cette réaction est provoquée lors de l'explosion d'une bombe thermonucléaire (ou bombe H) ; mais c'est elle aussi qui assure naturellement la production énergétique du Soleil. La réaction de fusion contrôlée constitue un enjeu énergétique, économique et environnemental de premier plan, c’est pourquoi elle est au cœur du projet ITER (International Thermonuclear Experimental Reactor), dont l’objectif est la construction d’un prototype de réacteur à fusion thermonucléaire contrôlée permettant de valider cette option comme source d’électricité. Dans le cas de la fission comme dans celui de la fusion, le dégagement d'énergie est corrélatif d'une diminution de la masse totale, conformément à la théorie de la relativité.
BIOLOGIE
Dans tous les organismes vivants, on admet l'existence constante de 27 corps simples : 11 non-métaux (carbone, hydrogène, oxygène, azote, soufre, phosphore, chlore, fluor, brome, iode, bore), 2 semi-métaux (silicium, arsenic) et 14 métaux (calcium, sodium, potassium, magnésium, fer, zinc, cuivre, nickel, cobalt, manganèse, aluminium, plomb, titane, étain). Les 11 éléments les plus abondants sont dits plastiques. Les autres sont des oligoéléments.